近日,深圳华大生命科学研究院联合中南大学湘雅医院通过对3000余株肺炎克雷伯菌进行全基因组测序与分析,发现了20条携带可移动粘菌素耐药基因(mcr)的质粒。研究团队通过挖掘mcr的水平基因转移机制,并与其他国家/地区的非人源质粒序列进行比对,揭示了mcr在动物-人-环境之间的传播风险。研究成果发表于学术期刊Microbiology Spectrum。

Microbiology Spectrum官网截图
多重耐药性最后的防线
粘菌素(colistin)是由多粘类芽孢杆菌产生的抗菌多肽,发现于1947年,对多重耐药的大肠杆菌、绿脓杆菌、肺炎克雷伯菌等革兰阴性菌有较强的抗菌作用。
近年来,因广谱抗生素的广泛使用,使得细菌耐药性日益增加。在致病菌耐药严重而新型抗生素研发缓慢的双重挑战下,粘菌素因其破坏细菌外膜完整性的杀菌机制,成为临床治疗多重耐药感染的最后一道防线。耐药基因“mcr“
目前,中国正在面临抗生素滥用的威胁,虽然医院已在控制抗生素的使用量,但还有一类隐秘的、不为人所知的抗生素来源——养殖户对药品的滥用,使得抗生素及相应耐药菌在食用肉中残留。
2015年,自我国首次在猪肉、鸡肉和人类样本中发现对粘菌素具有耐药性的基因“mcr-1” (mcr基因的亚型)以来,世界多个国家和地区都相继出现了mcr 阳性样本和病例的报道。
由于mcr 能通过移动元件介导,实现在不同细菌,甚至在人、动物和环境中循环传播,各国疾控、政府、学界对mcr 的传播都十分重视。
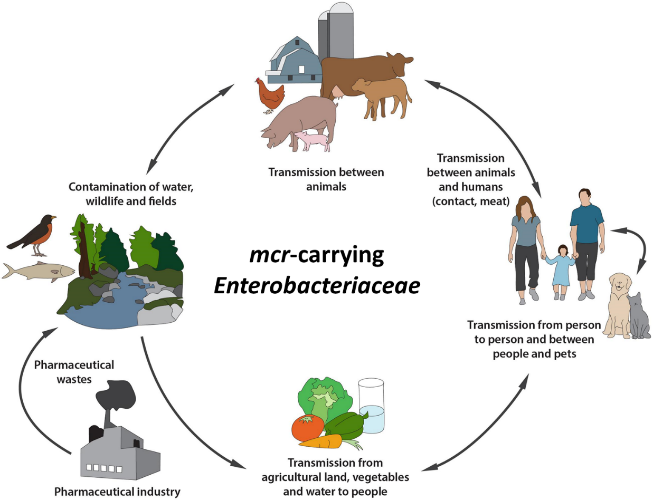
mcr 跨界传播示意图(图源:Frontiers杂志)
”mcr“的跨界转移及风险
本研究使用华大智造自主研发的DNBSEQ测序平台,并结合长读长测序,完成了对临床分离菌的全基因组深度测序。研究揭示临床mcr 阳性率约为0.7%(样本共3000余株,mcr 阳性菌为20株),其中,最新型mcr-10与mcr-9携带菌表型敏感,不能被传统诊断方法(如药敏试验)检出,显示了测序技术在耐药监测中不可替代的领先作用。
在20株mcr 阳性菌中,10株为多重耐药,17株产ESBL(超广谱β-内酰胺酶),4株为CRE(耐碳青霉烯类肠杆菌);其中,18株为肺炎克雷伯菌,另有2株属肺炎克雷伯菌的亚种Kpq和Kpv,研究首次在上述2种肺炎克雷伯菌的罕见亚种中发现了mcr-10.1 的存在。
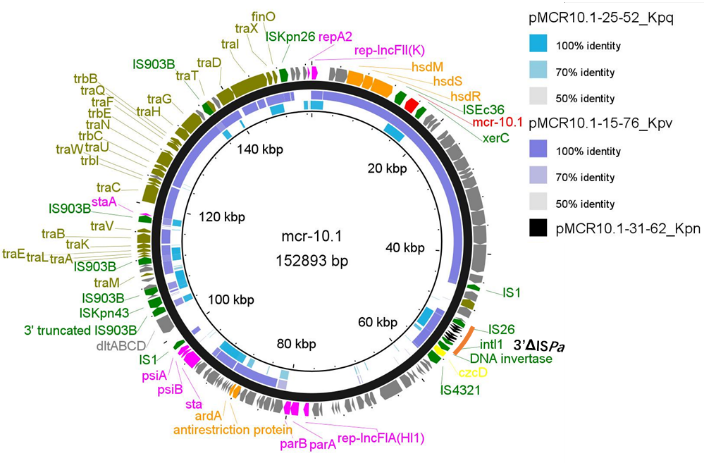
研究发现的3条mcr-10.1质粒新序列
比较基因组学还首次精准挖掘到mcr-10.1在质粒中的转座事件及其周边的反向重复序列,揭示了mcr-10.1 的水平基因转移机制。
ISEc36与XerC重组酶介导的mcr-10.1插入
小课堂
水平基因转移,是相对于垂直基因转移(亲代传递给子代)提出的,它打破了亲缘关系的界限,使得遗传物质传递给非子代,这也是细菌耐药的主要原因。
同时,研究揭示了临床mcr 阳性质粒与其他国家、地区所报道的非人源(银色海鸥、鸡和污水处理场)分离到的质粒序列存在高度同源性(核酸相似性>98.5%),揭示了mcr 在动物-人-环境之间的传播风险。
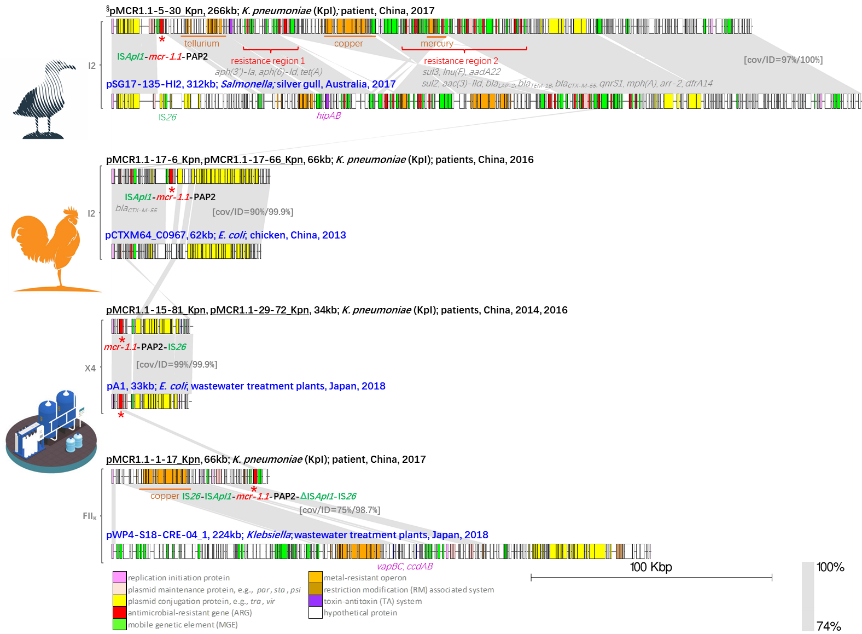
mcr-1人源质粒(黑标)与动物、环境
源质粒(蓝标)高度相似
综上,研究通过大规模筛查临床分离株的全基因组数据,挖掘到20条mcr 阳性质粒。首次在肺炎克雷伯菌的罕见亚种中发现mcr-10;比较基因组学复现了mcr-10.1的转座事件,且印证了mcr 动物-人-环境间的传播风险。
华大生命科学研究院裴娜博士、李俊桦研究员和中南大学湘雅医院检验科主任刘文恩教授为论文的共同通讯作者;华大生命科学研究院刘春娇博士、中南大学湘雅医院简子娟医生和华大生命科学研究院裴娜博士为论文共同第一作者。本研究已通过伦理审查,严格遵循相应法规和伦理准则。
1、Liu Y-Y, Wang Y, Walsh TR, et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study. The Lancet Infectious Diseases 2016; 16(2): 161-8.
【返 回】
上一篇:上海交大瑞金医院携手华大等机构发布首个中国人群血液病毒组图谱
下一篇:深圳华大生命科学研究院关于发布2022年度开放基金申报指南的通知
 联系我们
联系我们
 联系我们
联系我们
